قبل از مطالعه این مطلب بهتر است مطلب شیمی دان نمونه 1 را مرور کنید. اتم های عناصر مختلف با نسبت های متفاوت با هم ترکیب می شوند. برای مثال، سیلیسیوم با دو اتم گوگرد ترکیب می شود (فرمول سولفید سیلیسیوم SiS2 است) و دو اتم سدیم با یک اتم گوگرد ترکیب می شود (Na2S ). بنابراین تعیین نسبت اتم ها در هر ماده مرکب مهم است. فرض کنید لیستی از وزن های نسبی اتم ها را تهیه کرده ایم: به دلیل این که هیدروژن سبک ترین عنصر است، بیایید وزن آن را 1 در نظر بگیریم و وزن بقیه عناصر را با توجه به وزن آن یک پنجم کنیم: با توجه به جدول، اتم کربن چه قدر سنگین تر از بور است؟ الف) 12 برابر ب) 12/10 برابر ج) 10/12 برابر جواب: از جدول بالا می فهمیم که کربن و بور وزن اتمی نسبی 12 و 10 دارند، میانگین اتمی کربن از میانگین اتمی بور، سنگین تر است. برای همین میانگین اتمی کربن 12/10 برابر سنگین تر از میانگین اتمی بور است. چه جرمی از نقره شامل تعداد یکسانی از اتم های 12 گرمی کربن است؟ جواب این سوال 107 گرم است. جرم های جدول بالا نشان دهنده جرم های نسبی عناصر هستند. طبق جدول، میانگین اتمی نقره 107/12 = 8.9 دارای همان توده جرمی میانگین اتمی کربن است. برای همین، برای داشتن تعداد یکسانی از اتم های نقره، به جرم کربن نیاز داریم که 107/12 برابر جرمش است. از آن جایی که 12 گرم اتم کربن داریم، پس 107/12 x 12 = 107 g نقره داریم. چه جرمی از نقره دارای تعداد یکسانی از اتم های 6 گرمی کربن است؟ جواب: 107/2 = 53.5 g نقره، اگر نادرست حل کردید به سوال قبل برگردید و این نسبت را رعایت کنید: 6/12 = X/107 در اوایل قرن بیستم، طیف سنجی جرمی (اسپکترومتر جرمی) که به دانشمندان اجازه می داد تا جرم تک تک اتم ها را به صورت مجزا تعیین کنند، ساخته شد. این وسیله واقعیت هایی را کشف کرد از جمله این که تمام اتم های یک عنصر، جرم یکسانی ندارند (برای همین بود که به جای کلمه "اتم و وزن اتم" از "میانگین اتم" استفاده کردیم). اتم های یک عنصر دارای جرم های مختلفی هستند که "ایزوتوپ" نامیده می شود. برای مثال، دو ایزوتوپ مهم بور وجود دارد که هر دو دارای 5 پروتون در هسته هستند اما یکی از ایزوتوپ ها دارای 5 نوترون و دیگری دارای 6 نوترون است. می دانیم که جمع تعداد پروتون ها و نوترون ها در یک هسته، جرم ایزوتوپ را حاصل می کند. این تعداد به صورت یک بالا نویس در سمت چپ در کنار نماد شیمیایی عنصر نوشته می شود. برای مثال ایزوتوپ بور با 6 نوترون، 11B است. الکترون ذره دیگر موجود در اتم ها بسیار مورد علاقه شیمی دان هاست. الکترون ها در خارج از هسته و با بار منفی به دور هسته می چرخند. جرم الکترون از جرم پروتون یا نوترون بسیار کوچک تر است. بار روی الکترون با بار پروتون یکسان است اما علامت آن ها مخالف هم است. در نتیجه در یک اتم خنثی، تعداد الکترون ها و پروتون ها یکی است. کدام یک از ایزوتوپ های زیر دارای 6 پروتون و 7 نوترون است؟ الف) 7B ب) 13B ج) 12C د) 13C جواب: گزینه د صحیح است. کلر طبیعی موجود در طبیعت دارای دو ایزوتوپ است که یکی از ن ها دارای دو نوترون بیش تر از دیگری است. اگر ایزوتوپ سبک تر دارای عدد جرمی 35 باشد؛ نماد شیمیایی صحیح ایزوتوپ دیگر چیست؟ جواب : 37Cl نماد شیمیایی کلر Cl است و ایزوتوپ صحیح کلر بایستی دو عدد بیش تر از 35 باشد؛ یعنی 37. بعد از کشف ایزوتوپ ها و میانگین برای اندازه گیری های صحیح جرم نسبی ایزوتوپ ها، دانشمندان تصمیم گرفتند تا جرم ایزوتوپ 12C باید به صورت دقیق 12.0000 واحد وزن اتمی (amu) تعریف شود. در شکل بالا در a) یک هندوانه، 12 قطعه هندوانه در b) ، در حالت c) شما 12/1 هندوانه را می بینید و بالاخره در شکل d) می بینید که چگونه با این مقیاس می توان میوه های دیگر را وزن کرد. شیمی دان ها هم از کربن برای وزن کردن اتم ها استفاده می کنند. یک واحد وزن اتمی (amu) چگونه تعریف می شود؟ الف) 12 گرم ب) یک دوازدهم جرم یک اتم 12C ج) 1 x 10-12 گرم جواب صحیح گزینه ب است. جرم نوترون ها و پروتون ها بسیار نزدیک هم است. جرم یک الکترون حدود 2000 برابر کوچک تر از جرم یک نوترون یا پروتون است. جرم تقریبی یک پروتون و یا نوترون با واحد اتمی amu چه قدر است؟ الف) 12 amu ب) 6 amu ج) 1 amu جواب: گزینه ج درست است؛ در یک اتم کربن، 6 پروتون، 6 نوترون و 6 الکترون وجود دارد. وزن الکترون ها نسبت به پروتون ها و نوترون ها آن قدر کوچک است که می توان آن را نادیده گرفت. جرم یک پروتون نیز تقریبا با جرم نوترون برابر است؛ یعنی این هسته دارای جرم ترکیبی 12.00 amu است. برای همین یک پروتون (و یا یک نوترون) وزن 1.00 amu دارد. تنظیم: آلچالانلوشیمی دان نمونه 2

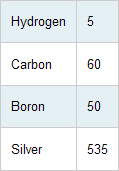
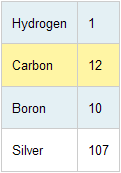
سوال 1:
سوال 2:
سوال 3:
ایزوتوپ ها:
سوال 4:
سوال 5:
سوال 6:
سوال 7:
نظرات شما عزیزان:




 آمار
وب سایت:
آمار
وب سایت:








